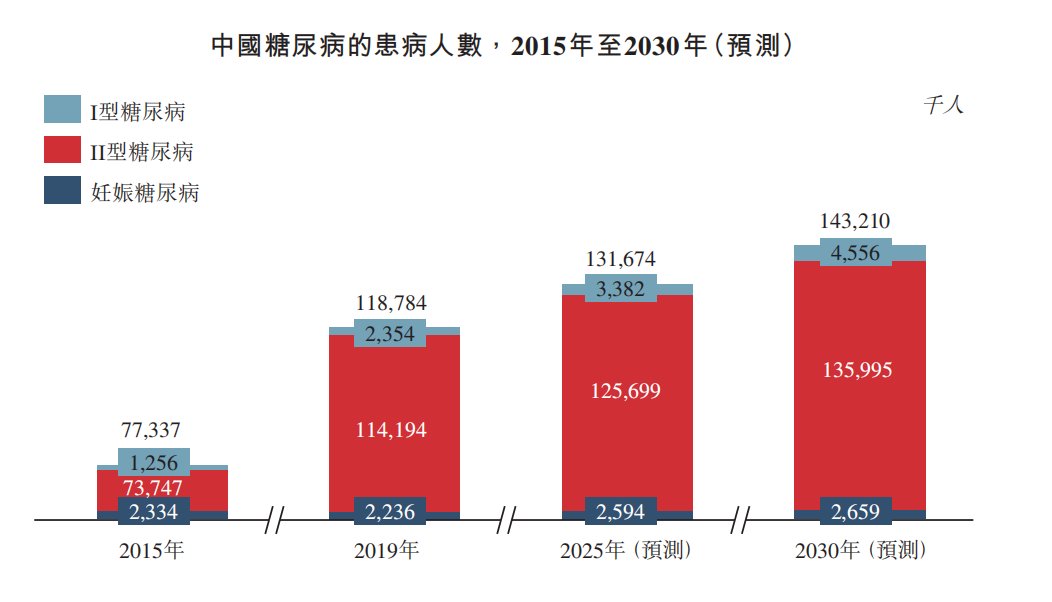
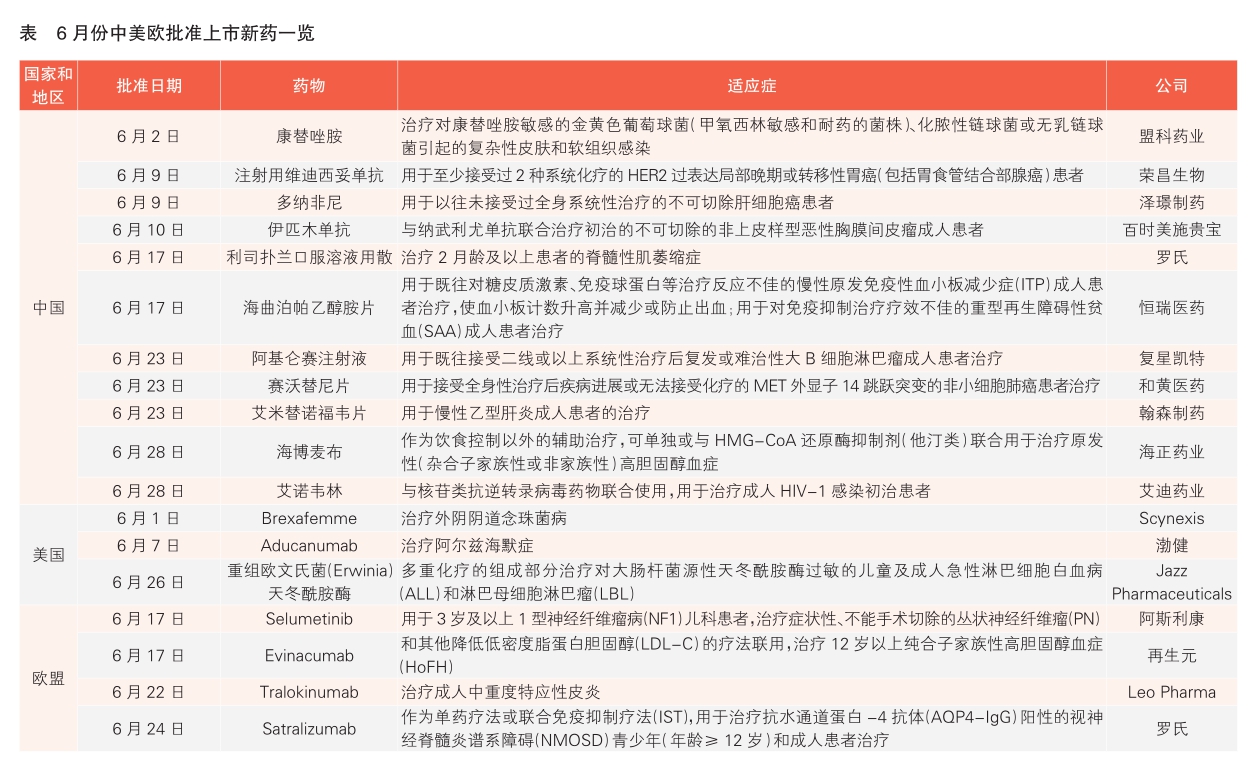
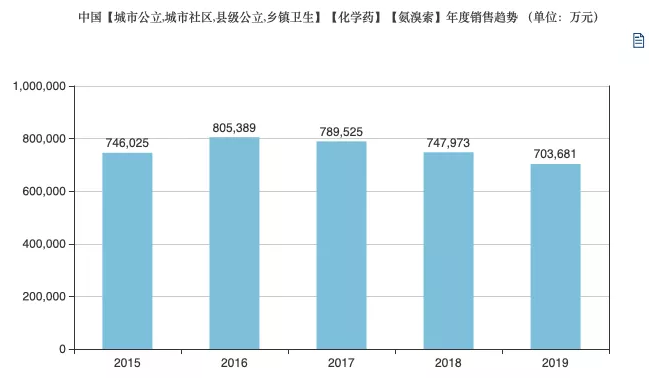
重磅!中国自己的第一个新冠中和抗体组合向FDA递交EUA申请,与默沙东形成差异化PK!
10月9日早,港股上市公司腾盛博药宣布其在研的BRII-196/BRII-198联合疗法向美国FDA提交了紧急使用授权(EUA)申请,支持EUA申请的数据于今日由公司滚动提交给美国FDA。
如此一来,腾盛博药EUA申请提交还早于国庆引起市场轰动的默沙东的莫努匹韦,更重要的是其未来顺利上市对中国创新药研发有着非凡的意义,因为这将是真正意义上第一个在美国获批上市的国产新冠特效药。对比该中和抗体与默沙东莫努匹韦(Molnupiravir)的临床数据和机理,腾盛博药的中和抗体将为新冠病患提供一个更有效、更安全的治疗方案。
如果顺利,BRII-196/BRII-198联合疗法有望在今年内获得FDA的批准。
一、申请EUA的底气,已披露的临床数据彰显抗体组合的有效性
也许令许多投资者好奇的是,在III期临床数据尚未完全披露的情况下,为何腾盛博药能如此快、甚至早于莫努匹韦提交EUA申请,有何底气?
归根结底,这离不开产品强劲的疗效&良好的安全性,以及公司团队超强的研发&执行能力。
在公司10月4日发表的ACTIV-23期试验的中期数据显示,BRII-196/BRII-198与安慰剂相比,住院和死亡风险降低78%,治疗组3级或以上的不良事件(AE)少于安慰剂组,分别为3.8%和13.4%。疗效数据上,时下爆火的默沙东莫努匹韦(Molnupiravir)仅能降低50%住院或死亡风险,相比之下,腾盛博药的联合疗法具备明显优势。莫努匹韦作为一个诱导基因突变的药物,长期安全性更是收到广泛质疑。而来自于人自身的中和抗体,在安全性上让人放心。
同时研究结果表明,BRII-196/BRII-198联合疗法对大多数发病后晚期得到治疗的患者仍然有效,并且有潜力将临床益处扩展到获得及时治疗有挑战的真实世界患者。
侧面看,腾盛博药的全球III期临床和国内二期临床分别获得了代表美国最高水平的国立卫生研究院(NIH)和顶级传染病专家钟南山院士的竭力支持,如此豪华的阵容一方面验证了专家智脑们对于产品本身的肯定,另外也对公司获得监管层面快速审批有非常大的帮助。
值得一提的还有BRII-196/BRII-198联合疗法超快的推进速度。2020年3月底正式立项开始研究,2020年底已进入国际临床III期,顺利就将于2021年内获批,如此惊人的研发、执行效率,很难不让市场将此归功于腾盛博药团队的超强的研发能力和执行力。
公司已经为BRII-196/BRII-198联合疗法商业化做好了准备,不仅追加了1亿美金用于推进商业化,还新招募一员大将CoyStout,曾任吉利德的美国商业及医保准入副总裁,曾领导了30多个产品上市中的市场及医保准入工作,具备丰富的海外商业化经验。
二、默沙东神药终结新冠疫情?背后隐忧或加强中和抗体独特的差异化优势
1、莫努匹韦(Molnupiravir)的潜在缺陷,为获批留下了更多不确定性
虽然莫努匹韦(Molnupiravir)不错的临床数据引起的市场极大关注,但其同时也暴露了一些缺陷:潜在的安全性风险和适应证范围受限。
莫努匹韦(Molnupiravir)主要作用点是针对新冠复制过程中必不可少的复制自身RNA基因组的过程,与吉利德公司的瑞德西韦有类似之处。不过不同于瑞德西韦直接抑制病毒的RNA复制酶,莫努匹韦(Molnupiravir)是让病毒复制RNA的过程中引入错误的碱基,从而使病毒不能正确复制形成子代病毒。
而莫努匹韦(Molnupiravir)本次宣布成功的临床试验是针对出现轻到中的症状5天之内并且没有打过疫苗的病人,该药物之前针对重症的临床试验都毫无悬念失败了,是因为本身机理是抑制病毒复制,对于重症病人来说已经过了病毒复制高峰期,作用显著降低是大概率事件,所以药物整体的适应证范围受限于轻中症病人群体。
目前默沙东还没有公布莫努匹韦(Molnupiravir)有哪些副作用,不过值得注意的是,该药物在早前其他适应症开发上被发现对子代的遗传产生基因突变的缺陷,曾在HIV感染治疗临床试验中因毒性停止研究,所以该药物的潜在毒性也令市场担忧,这样也给其能否顺利EUA留下了更多的不确定性。
2、小分新冠口服药带来的疫情趋势
由于新冠口服药物可减少患者进展到重症的概率,被感染的轻中症患者会就医和自行购买药物服用,所以在心理层面上新冠口服药的面市将打消一部分人群的疫苗接种意愿,并导致未来携带病毒的自由活动人群将增加。但由于默沙东的口服药并不能防止感染,感染新冠病毒的总人群将扩大,新冠进一步流感化。
3、中和抗体的差异化市场机会
前面提到腾盛博药BRII-196/BRII-198联合疗法相较于莫努匹韦(Molnupiravir)有更高的有效性和安全性,不仅如此,针对莫努匹韦(Molnupiravir)适应症覆盖人群较窄的劣势,腾盛博药BRII-196/BRII-198联合疗法展现出更广阔的开发前景和更大范围的患者群体。
在最新发表的基于837名受试者部分随访的III期试验中期分析显示,使用BRII-196/BRII-198治疗与更晚的(首发症状后6-10天)使用均能为患者带来临床获益,意味着其可用于轻中症更晚期的患者。
另外,中和抗体还可以应用于预防适应症。10月5日,阿斯利康宣布向FDA提交长效抗体鸡尾酒疗法AZD7442的EUA,如获得批准,那么它将是第一个拿到EUA用于预防新冠的长效抗体鸡尾酒疗法。值得注意的是,腾盛博药的这对中和抗体于阿斯利康的一样是长效抗体鸡尾酒。因此,除了治疗之外,在预防领域腾盛博药的中和抗体有巨大的应用空间。针对未接种疫苗且免疫力低下的老人小孩群体、暴露前后的高危人群、过敏体质不敢打疫苗的人、又或是接种疫苗后未及时产生中和抗体的人群等都可以预期这对中和抗体会产生保护作用。
三、战略性防疫物资:属于中国自己的国产新冠特效药
从莫努匹韦(Molnupiravir)的目前公布的III期数据看,招募的受试者分布为:拉美人群占55%、欧洲人群占23%、非洲人群占15%,显然缺少亚裔受试者数据。
按照部分发达国家在疫苗分发中的做法,中国研发自己的新冠特效药迫在眉睫。
1、带有战略物资属性的新冠特效药
口服药的出现将进一步松动全球防疫措施,中国国门不可能永远紧锁,所以国内需要形成自己的防疫药物战略储备。在国家层面,仅仅是新冠疫苗显然不够,同时需要自己的特效药,构建“新冠疫苗+药物”更全面有效的组合。
从国内厂商中和抗体的研究进展来看,腾盛博药BRII-196/BRII-198联合疗法无论是海外还是国内的进度都遥遥领先,海外三期临床年内完成&国内二期临床已经进入尾声,而其他国内厂商如绿叶制药的LY–CovMab、济民可信的JMB2002、复宏汉霖的HLX70等都处于早期临床阶段。
即便将进度最快的国产小分子口服药物普克鲁胺纳入视野,距离能获得大规模高质量三期数据也还需要时间。
不出意外,腾盛博药BRII-196/BRII-198联合疗法将成为第一个真正意义上在国内面市的“原创+国产”新冠中和抗体特效药。
2、冬季疫情易反复,腾盛博药一众厂商有望加速推进国内临床
全球秋冬疫情的反弹不可避免,这有理论和事实依据双重支撑。
以和新冠最接近的非典为例,气温日较差和SARS发病率呈现了一定关系,如果发生了单日内气温剧烈波动的情况,也就是气温日较差大,那么SARS发病数就会增加,新冠也不例外。
去年二季度,世界各国通过防疫措施有效控制住疫情,但一到秋冬季节,许多国家纷纷出现了疫情的反弹,不得不开启了第二波的隔离封闭措施。
不仅如此,对待即将到来的北京2022年冬奥会,我国将接待大量海外入境运动员,这也给国内的防疫部门增添了一定的挑战。入境人员的增加意味着输入病例将大量增加,这对于和政府公共卫生部门合作密切的腾盛博药、开拓药业等一众厂商带来了加速产品临床推进、尽早在国内实现商业化的契机。
3、商业化后的产能供应和定价范围引人关注
新冠特效药物的产能供应能否满足社会日益增长的需求一直是市场关注的问题,今年7月开始,美国的新冠中和抗体药物的订购量和使用量增加了20倍,出现了中和抗体药物短缺的问题,相信这一问题同样有可能出现在更多患者感染新冠的未来背景下。而腾盛博药的CDMO合作伙伴为药明生物,即便不考虑腾盛早前的大量储备库存,药明生物强大的生产能力相信也足以为腾盛博药后续向市场足量供应保驾护航。
拎出中和抗体和小分子药物比较,不可回避的问题其实是生产成本的劣势,小分子药物制备工艺相对简单成熟、可快速批量制造、成本较低的特点使得其可及性优于如中和抗体等抗体药物,不过随着中和抗体生产工艺成熟+批量生产的规模化效应显现,中和抗体定价一定会结合各国国情,让更多病人获益的同时获得可观的回报。目前美国采购中和抗体和默沙东小分子药物一个疗程的价格分别是2100美金和700美金,更有效更安全但要更贵的中和抗体和有效性安全性都在劣势但更便宜的小分子药,这会是未来摆在大家面前的一个选择。
结语:市场许多人只看到默沙东莫努匹韦(Molnupiravir)的临床成功对于其他在研药物的冲击,却未曾看到其他更有潜力在研药物可能给其带来的差异化竞争,这显然是短视的。
更为重要的是,在新冠流感化趋势确认的时代潮流下,中国有自己的国产原创新冠特效药获批上市的意义是深远的,即便无法估量其庞大的市场空间,也要认识到背后研发厂商真核的药物创新能力。